新しい医療への取組み
1.臨床研究実施方針
慶應義塾大学病院は、未来のよりよい医療のため、次の方針に基づく臨床研究を行います。
(1)被験者の保護
被験者の身体の安全、プライバシーの保護、人権の尊重を第一とし、インフォームド・コンセントは丁寧な説明による十分な理解に基づいて受けます。
(2)法令等の遵守
法令、倫理指針等を遵守し、社会の一員として求められる責任を果たします。
(3)公正な研究活動
気品の泉源、智徳の模範たる組織として、不正を容認せず、倫理と科学の両面で信頼される研究成果を追求します。
(4)人材育成
未来の医療を拓く質の高い研究者、医療人を育成します。
(5)社会への還元
未来社会の発展のため、他施設への支援や相互協力を行い、研究成果の実用化を促進します。
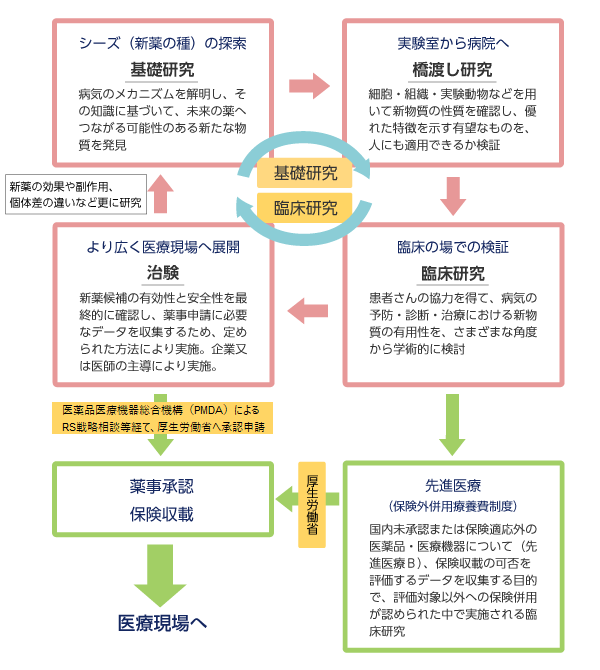
基礎・臨床一体型の先進的な医療、個別化治療に向けて
2.臨床研究実施状況
実施中の臨床研究および治験については、こちらをご覧ください。
3.患者さんの権利と安全に配慮した臨床研究
- (1)臨床研究について
-
 慶應義塾臨床研究審査委員会
慶應義塾臨床研究審査委員会「臨床研究」とは、患者さんにご協力頂き、病気の原因の解明、病気の予防・診断・治療の改善、患者さんの生活の質の向上などのために行う医学的研究です。厚生労働省の定める指針および一部の臨床研究は法律にもとづき実施されます。厚生労働省の指針には、倫理審査委員会の審議の透明化や情報公開、インフォームド・コンセント(同意)を受ける手続、被験者の健康被害に対する補償措置や予期しない重篤な有害事象に対する対応、関係者の教育研修、および臨床試験計画の事前登録などが盛り込まれており、患者さんの権利と安全を第一に考えられています。倫理審査委員会は、医学・医療の専門家、法律学の専門家、人文・社会科学分野の専門家、一般の立場を代表する者等から、男女バランスよく構成されたメンバーで科学的かつ倫理的な側面も踏まえて審査され、研究計画に加え、患者さんの利益・不利益がわかりやすく説明された説明同意文書であるかどうかの確認等が行われます。(慶應義塾大学医学部 倫理委員会、慶應義塾臨床研究審査委員会)
なお、臨床研究のうち、診療データ等の情報や余った検体のみを用いる研究については、国が定めた倫理指針に基づき、対象となる患者さんから直接同意を受けない場合があります。この場合は、あらかじめ研究内容の詳細をWebサイトにて公開し、患者さんが拒否できる機会を設けており、このような手法を「オプトアウト」といいます。研究のためにご自身のデータや検体が使用されることを望まない方は、各研究の担当者までお知らせください。なお、同意の有無が今後の診療などに影響することはございません。
- (2)治験について
-
新しい薬が政府の承認を得て一般の診療で使えるように、客観的なデータを集めることを目的とした臨床研究は、「治験」と呼ばれます。治験は、健康増進に役立つ新しい手法や療法を見極め、製造販売承認申請に必要な臨床試験の試験成績に関する資料の収集を目的とする試験です。被験者の自発的な参加を得て行われます。実験動物等で認められた効果や安全性を人で確認するため、科学的に評価できるデータとして倫理性・信頼性基準(GCP:Good Clinical Practice)のもとで収集することが求められます(慶應義塾大学病院治験事務局)。
GCPは、薬事法下の厚生労働省令で定められた基準です。治験が十分な倫理的配慮のもとに科学的に適正に実施されるために必要な事項を定めたもので、厳密な運用が行われています。
また、安全性や薬物動態を調べることを目的とし健常者を対象としたFIH (First in Human) 試験、患者さんを対象とした First in Patient 試験やPOC(Proof of Concept)試験など早期臨床試験の実施に対応可能な臨床試験病棟を設置しています。
4.臨床研究推進センター
基礎研究で得られた成果を、患者さんのニーズに合った革新的な治療法や診断技術に結びつくよう実用化を推進するとともに、迅速かつ一気通貫で先進医療を医療現場に提供するため、2014年8月1日に大学病院長の下、臨床研究推進センターが設置されました。同センターは、ネットワーク支援、トランスレーショナルリサーチ、再生医療等支援、臨床研究支援、生物統計、臨床研究実施、生体試料研究支援、臨床研究企画推進、教育研修、広報等の部門を擁し、それぞれに各領域の専門スタッフを配置しています。医師主導・企業治験の実施に加えて、基礎研究・非臨床試験段階の研究シーズにおいても臨床試験へむけた支援を行います。また、運営委員会、シーズ評価委員会および再生医療等推進委員会を設け、医学部と病院の各部門が協調し、切れ目のない研究開発を実施します。同センターを通じて、慶應義塾伝統の基礎・臨床一体型 医療・医学を効果的に支援し、世界に先駆けた革新的な医薬品、医療機器を創出する拠点形成を目指します。
5.再生医療の推進に関わる取組み
- ヒト体性幹細胞原料の安定供給促進事業
当院では、安全で有効な再生医療を推進するための取組みの一つとして、再生医療等製品の製造支援のために、手術などで摘出され通常は廃棄される組織や細胞を、倫理委員会等の所定の院内手続きに従い、あらかじめ患者さんの同意を得たうえで、再生医療等製品を製造しようとする製薬企業等に、継続的に、かつ安定した品質で提供することで、再生医療等製品の開発の活発化を目指しています。